IL MIELOMA MULTIPLO
Il mieloma multiplo è un tumore del sangue che coinvolge le cellule deputate alla produzione di anticorpi o immunoglobuline (proteine presenti nel sangue) chiamate plasmacellule che, fisiologicamente, risiedono nel midollo osseo. Il midollo osseo è l’organo predisposto alla produzione delle cellule del sangue (globuli rossi, globuli bianchi, piastrine) e si trova dentro le ossa (vertebre, coste, bacino, femori, etc). Nel mieloma le plasmacellule assumono caratteristiche di tipo maligno, proliferano in continuazione e gradualmente tolgono spazio alle cellule normali del midollo. Le cellule malate rilasciano sostanze chimiche infiammatorie (citochine) che tendono ad assottigliare il tessuto osseo normale, causando dolori ossei e fratture diffuse.
Inoltre producono una proteina anomala, chiamata componente monoclonale, che può essere riscontrata nel sangue o nelle urine. Le immunoglobuline normali (anticorpi) hanno un ruolo molto importante all’interno del sistema immunitario dell’organismo, nella difesa dalle infezioni, poiché riconoscono i microbi che lo invadono e ne permettono l’identificazione e la successiva eliminazione. Al contrario, l’immunoglobulina monoclonale
prodotta dalle cellule del mieloma non è funzionante ed anzi interferisce con la produzione delle immunoglobuline normali, causando una particolare suscettibilità del paziente alle infezioni oltre che danneggiare l’organismo a livello micro vascolare, in particolare a livello renale.
INCIDENZA
Il mieloma rappresenta l’1,2% di tutti i tumori e il 13% delle neoplasie ematologiche, con un’incidenza media
ogni anno di 9,5 casi ogni 100.000 uomini e 8,1 ogni 100.000 donne. E’ una patologia dell’età avanzata (età mediana alla diagnosi 70 anni) con un’incidenza nel complesso stabile ma una prevalenza in aumento
considerato l’allungamento della vita, mentre la mortalità è in calo negli ultimi anni.
CLASSIFICAZIONE
La componente monoclonale, come tutti gli anticorpi, è formata da due proteine di grandi dimensioni (chiamate catene pesanti) e due proteine più piccole (catene leggere). Queste proteine presentano una certa variabilità strutturale, che viene utilizzata per la classificazione delle componenti monoclonali:
– le catene pesanti possono essere di isotipo G o A, molto più raramente D o M;
– le catene leggere possono essere di isotipo kappa (k) o lambda (λ).
Figura 1: la componente monoclonale, costituita da due catene pesanti e due leggere

Per distinguere le diverse gammopatie monoclonali si usano tre parametri:
– la quantità di componente monoclonale nel sangue;
– la percentuale di plasmacellule nel midollo osseo;
– l’eventuale presenza di sintomi legati alla gammopatia.
È possibile in questo modo identificare tre condizioni cliniche:
– Gammopatie monoclonali di significato indeterminato (chiamate anche MGUS): la componente monoclonale è < 3 g/dl, la percentuale di plasmacellule nel midollo osseo è < 10% e non ci sono sintomi clinici di rilievo.
– Mieloma multiplo: la percentuale di plasmacellule nel midollo osseo è ≥ 10%, e può essere associata a una componente monoclonale nel sangue ≥ 3 g/dl.
In circa il 10-15% dei pazienti affetti da mieloma multiplo le plasmacellule tumorali producono solo catene leggere (mieloma micromolecolare).
Più raramente (nell’1–2% dei pazienti) le cellule del mieloma non producono anticorpi o ne producono quantità minime
(mieloma non secernente).
Figura 2: Elettroforesi siero proteine in paziente con MM secernente a sinistra e con MM non secernente o micromolecolare a destra
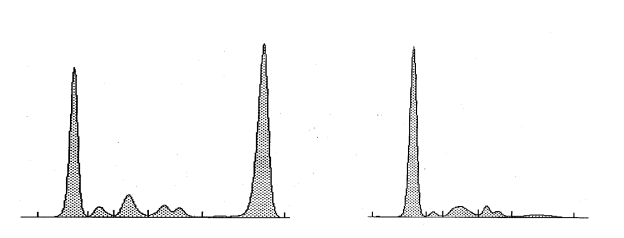
La presenza di sintomi legati alla malattia permette di distinguere i casi di mieloma multiplo sintomatico dai casi di mieloma multiplo asintomatico.
– Plasmocitoma solitario è un tumore raro, caratterizzato dall’accumulo di plasmacellule tumorali in una ristretta zona del corpo. Le plasmacellule nel midollo osseo sono inferiori al 10%, la componente monoclonale è spesso di piccola entità o assente, e non sono presenti i sintomi tipici del mieloma multiplo.
SINTOMI E SEGNI
Il mieloma multiplo può manifestarsi con sintomi eterogenei. In un terzo dei casi il riscontro è occasionale attraverso l’esecuzione dell’elettroforesi delle sieroproteine in corso di esami di routine. Quando il mieloma è sintomatico, nel 50% si presenta con localizzazione ossea, nel 10-20% con insufficienza renale.
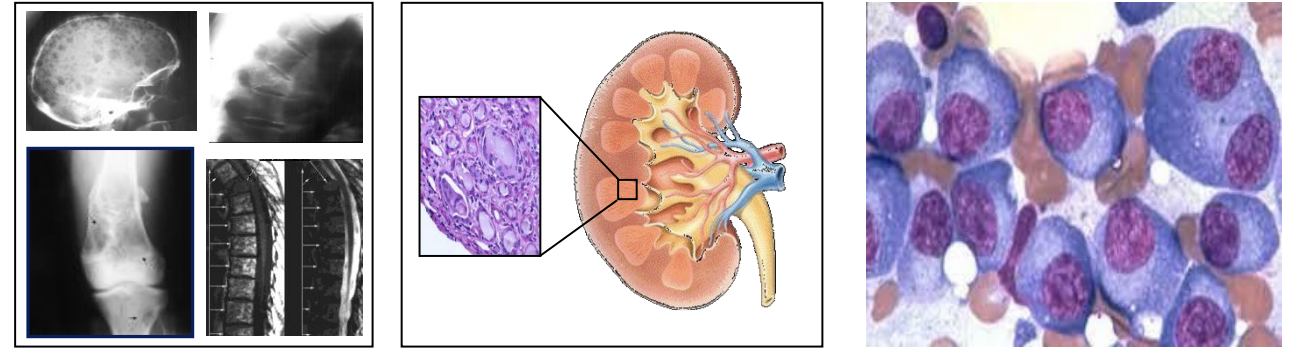
Molto spesso il primo sintomo del mieloma multiplo è rappresentato dal dolore osseo (60%), che è generato dall’invasione delle plasmacellule nel midollo osseo. Il dolore osseo viene aggravato dai movimenti, soprattutto a livello delle coste e della colonna vertebrale. A livello delle ossa possono verificarsi lesioni litiche e fratture, più spesso a carico dei segmenti ossei sottoposti a carichi di lavoro continuo (ad esempio le vertebre).
I pazienti possono sviluppare anemia (70%), e come diretta conseguenza avvertire stanchezza importante e facile affaticabilità. Un danno renale si riscontra nel 20-40% dei pazienti alla diagnosi. Le infezioni ricorrenti (per esempio bronchiali, polmonari o delle vie urinarie) sono un altro segno della malattia.
L’elevazione dei livelli di calcio plasmatico sono elevati solo in una piccola frazione dei pazienti provocando confusione mentale. La presenza di grandi quantità di componente monoclonale aumenta la viscosità del sangue, fino a causare mal di testa e confusione, e può bloccare l’afflusso di sangue al cuore o al cervello, causando infarto o ictus.
Figura 3: I sintomi del Mieloma Multiplo: le lesioni litiche, la precipitazione delle catene leggere a livello del rene, l’infiltrato midollare di plasmacellule
CAUSE
Le cause del mieloma multiplo sono ancora sconosciute. Alla base della malattia, come nella maggior parte delle neoplasie maligne, vi sono alterazioni acquisite (non ereditaria!) del DNA di una o più sottopopolazioni cellulari (cloni). Nel caso del mieloma queste alterazioni si verificano inizialmente durante la sequenza di
sviluppo e maturazione dei linfociti B e quindi successivamente anche in altri processi legati alla proliferazione cellulare. Alla luce delle più recenti scoperte scientifiche sembrerebbe che tutte le forme di mieloma derivino da una condizione benigna chiamata MGUS (gammopatia monoclonale di incerto significato) rappresentata da un modesto accumulo di plasmacellule malate a livello midollare in assenza di sintomi clinici. Tale MGUS può evolvere in mieloma solo in una piccola frazione dei casi e necessita solo di
controlli annuali.
DIAGNOSI
La diagnosi di mieloma viene talora posta in seguito allo svolgimento di normali esami di controllo, prima che la malattia abbia causato dei sintomi.
La diagnosi di mieloma si fonda su due elementi clinici:
1) aumento significativo del numero di plasmacellule maligne all’interno del midollo osseo, rilevabile mediante aspirato midollare per morfologia e citoflurimetra e biopsia ossea (eseguiti a livello della cresta iliaca posteriore del bacino) che confermano la presenza di plasmacellule clonali e danno la percentuale di infiltrato. Viene anche effettuata la “fluorescent in situ hybridization” (FISH) per la valutazione dell’assetto cromosomico delle plasmacellule in esame
2) presenza di immunoglobuline monoclonali nel sangue e di proteina di Bence-Jones nelle urine, entrambi
rilevabili tramite tecnica di elettroforesi o immunofissazione. La proteina di Bence-Jones è costituita solo da una parte degli anticorpi monoclonali, le cosiddette “catene leggere” Kappa o Lambda. Se il mieloma secerne solo catene leggere viene definito micromolecolare.
Dopo che la componente monoclonale è stata tipizzata e quantificata, bisogna identificare gli eventuali danni
causati dalla malattia a organi e tessuti. A questo scopo si utilizzano:
– l’emocromo, cioè la conta delle cellule del sangue, che serve a valutare la funzionalità del midollo osseo;
– gli esami chimici del sangue, che misurano la funzionalità renale e la quantità di calcio nel sangue.
– gli esami radiologici, come la TAC dello scheletro, che permettono di valutare la presenza e l’entità
delle lesioni ossee associate alla malattia. Possono seguire esami ancora più approfonditi, come la risonanza
magnetica (RMN) rachide e bacino o whole body e la PET-CT, che permettono di studiare più in dettaglio le
singole lesioni.
PROGNOSI
Ad oggi si utilizzano per stratificare l’aggressività della malattia dei criteri laboratoristici (International
Staging system score basato su livelli sierici di 2 proteine: albumina e beta 2 microglobulina) e genetici
(presenza di determinate mutazioni genetiche come la traslocazione t(4,14), l’amplificazione 1q21 o la
delezione 17p13).
I trattamenti attuali non permettono in genere di ottenere una guarigione, ma possono garantire un buon
controllo della malattia per periodi sempre più prolungati.
TERAPIA
Una volta posta la diagnosi di mieloma multiplo bisogna capire se la malattia sia sintomatica (symptomatic myeloma) o no (smoldering myeloma), ovvero se stia già danneggiando il fisico. Nella maggior parte dei casi questi sintomi sono legati a livelli elevati di calcio nel sangue, ad insufficienza renale, ad abbassamento dei valori di emoglobina ed alla presenza di lesioni ossee evidenziabili con radiografie, TAC o risonanza magnetica (criteri CRAB).
Figura 4: Criteri di trattamento del Mieloma Multiplo sintomaticoMieloma Multiplo sintomatico
Per ciò che concerne i criteri di sintomaticità del mieloma, l’IMWG ha introdotto, accanto ai noti criteri CRAB, tre nuovi myeloma defining events (MDE) o slimCRAB, ossia quegli elementi clinico-laboratoristici in presenza dei quali si può definire il mieloma come sintomatico e pertanto meritevole di trattamento:
– ≥60% di plasmacellule monoclonali midollari;
– rapporto tra catene leggere libere sieriche kappa e lambda (catena coinvolta / catena non coinvolta) > 100 (la catena coinvolta deve essere presente in misura superiore a 100 mg/L);
– ≥ 1 lesione focale in RMN.
Da un punto di vista terapeutico le possibilità di cura di questa malattia sono molto migliorate negli ultimi 15 anni passando da una situazione in cui la disponibilità di farmaci efficaci era molto scarsa a una situazione odierna con molteplici nuovi farmaci «target» e nuove combinazioni. La strategia terapeutica è
essenzialmente correlata all’età e allo stato del paziente.
Pazienti candidabili a trapianto autologo di cellule staminali
Per i pazienti in buone condizioni cliniche generali e non anziani (solitamente si usano i 70 anni di età come soglia), si utilizza un trattamento iniziale (terapia di induzione) basata su una associazione di quattro farmaci (Daratumumab, bortezomib, talidomide e desametasone) che permette di ridurre rapidamente la
quantità di cellule tumorali e di alleviare i sintomi. Una rivoluzione, nell’approccio terapeutico, è rappresentata dall’aggiunta dell’anticorpo monoclonale antiCD38 (Daratumumab). Un anticorpo è una grande proteina che viene generata come parte del normale sistema immunitario per neutralizzare oggetti estranei come batteri e virus. Daratumumab è un anticorpo destinato specificamente a individuare ed eliminare un particolare oggetto dannoso nel corpo, in questo caso cellule plasmatiche cancerose. Non è una chemioterapia. Daratumumab agisce direttamente uccidendo le plasmacellule neoplastiche e/o aiutando il sistema immunitario a distruggerle. Tale terapia viene somministrata ambulatorialmente ed è generalmente ben tollerata.
I risultati ottenuti con questo approccio vengono poi consolidati dal trapianto di cellule emopoietiche autologhe. La prima fase della procedura consiste nella mobilizzazione delle cellule staminali: grazie alla somministrazione di appositi farmaci, le cellule staminali del paziente si spostano dal midollo osseo (dove si trovano normalmente) nel sangue. Le cellule staminali vengono poi prelevate dal sangue e conservate a bassissime temperature (criopreservate). La fase successiva consiste nella somministrazione di una
chemioterapia ad alte dosi, seguita dalla reinfusione delle cellule staminali criopreservate. La chemioterapia
ad alte dosi (melphalan) causa una importante citopenia (riduzione delle cellule del sangue), che espone il paziente ad un elevato rischio di infezioni. Per questo, durante la fase di citopenia, il paziente è ricoverato in una camera sterile.
Dopo il trapianto il paziente viene avviato a una breve terapia di consolidamento analoga all’induzione e a una terapia di mantenimento con Lenalidomide. Durante il follow-up il paziente viene seguito con
periodiche visite ed esami ematochimici di controllo.
Pazienti NON candidabili a trapianto autologo di cellule staminali.
Per i pazienti anziani o non in buone condizioni cliniche generali che non possono eseguire un trapianto autologo vengono eseguite invece terapie più blande che possono comprendere bortezomib in associazione a cortisone e melphalan (VMP) o a lenalidomide e cortisone (VRD) oppure solo lenalidomide più cortisone (RD). L’obiettivo è ottenere la migliore risposta possibile per garantire un controllo prolungato della malattia.
L’aggiunta di daratumumab agli attuali schemi Rd e VMP è in grado di incrementare i tassi e la profondità delle risposte ottenute.
Pazienti con malattia recidivata o refrattaria
Il trapianto di cellule staminali autologhe e l’introduzione di numerosi farmaci efficaci contro le cellule mielomatose ha permesso di creare strategie terapeutiche differenti, mirate da una parte all’eradicazione del
clone plasmacellulare midollare per un controllo a lungo termine della malattia, dall’altra alla cronicizzazione della patologia stessa mediante farmaci in grado di mantenere le plasmacellule monoclonali in una fase di latenza sia biologica che clinica. Se la malattia ricade o progredisce dopo questa prima linea terapeutica, la qualità e la durata della risposta
ottenute dalle terapie precedenti guidano la scelta. Un eventuale trapianto autologo di cellule emopoietiche può in certi casi essere usato anche in seconda linea per consolidare la risposta. In casi selezionati anche il trapianto allogenico di cellule emopoietiche da donatore può consentire l’ottenimento di risposte prolungate.
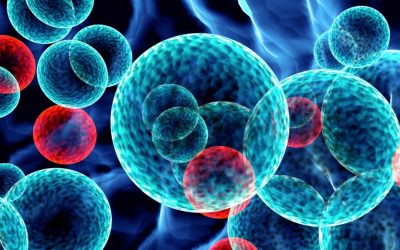
Sono stati recentemente approvati numerosi farmaci che si possono utilizzare dalla seconda linea di terapia in avanti quali Carfilzomib, Ixazomib, Daratumumab, Pomalidomide, Isatuximab, Selinexor in varie associazioni (tabella 1)
Tabella 1. I farmaci per il trattamento del mieloma multiplo
Recentemente sono stati approvati in linee terapeutiche più avanzate gli anticorpi monoclonali
Bispecifici (BiTes) e le CAR-T.
I BiTes sono anticorpi monoclonali, sintetizzati in laboratorio utilizzando tecniche di bioingegneria o di
ingegneria genetica, in grado di guidare le cellule del sistema immunitario verso quelle del tumore e
combattere le cellule malate. Una tecnologia che è oggi in grado di dare risultati significativi nella maggior
parte dei pazienti. Attualmente, approvati dalla IV linea di trattamento in avanti sono Teclistamab,
Talquetamab ed Elranatamab.
Figura 5: BiTes
CAR-T (chimeric antigen receptor T cell) è una metodica volta a potenziare il sistema immunitario del
paziente. I linfociti T vengono prelevati e riprogrammati in laboratorio per creare cellule T geneticamente
modificate e dotate di un recettore in grado di riconoscere e combattere le cellule tumorali.
Figura 6: CAR-T
Effetti collaterali delle terapie
Chemioterapia
La chemioterapia è un trattamento citotossico, che uccide preferenzialmente le cellule che si riproducono
rapidamente, come le cellule tumorali. Anche alcune delle normali cellule del corpo sono sensibili alla
chemioterapia, soprattutto quelle che formano i capelli, quelle che rivestono l’apparato digerente e le stesse
cellule del sangue. Per questo la chemioterapia porta molto spesso alla perdita dei capelli (che però
ricrescono qualche mese dopo l’interruzione della terapia) e può causare nausea (che può essere controllata
con opportuni farmaci), infiammazione della bocca e disturbi intestinali (diarrea, stipsi).
L’eliminazione delle cellule del sangue dovuta alla chemioterapia aumenta il rischio di emorragie (a causa dei
ridotti livelli di piastrine) e di infezioni (a causa dei ridotti livelli di globuli bianchi), e può causare spossatezza
(a causa della riduzione dei livelli di emoglobina). Per combattere questi sintomi si usano trasfusioni di
sangue o di cellule del sangue, e farmaci antibiotici o antifungini, fattori di crescita.
Tutti questi effetti collaterali sono temporanei, si possono controllare con farmaci specifici e si risolvono
gradualmente, in tempi più o meno lunghi, dopo la fine della chemioterapia. Grazie all’uso delle terapie di
supporto, l’incidenza degli effetti indesiderati è molto minore rispetto al passato.
Inoltre, non è detto che tutti i pazienti sviluppino questi effetti collaterali, dato che ci sono differenze
individuali nella reazione ai farmaci, e uno stesso paziente può avere effetti collaterali diversi in diversi cicli di
chemioterapia. L’assenza di effetti collaterali non indica assolutamente che la terapia non stia funzionando.
Corticosteroidi
I corticosteroidi sono farmaci simili a sostanze naturalmente presenti nel nostro corpo, quando vengono
assunte alle dosi e per i tempi necessari al trattamento possono causare effetti collaterali di vario tipo.
Per quanto riguarda l’umore e il comportamento, possono avere un effetto stimolante, mobilitando le energie
del corpo, ma anche causare disturbi del sonno, insonnia, agitazione, irascibilità e aumento della pressione
sanguigna. Possono far aumentare la produzione di succhi gastrici e quindi causare bruciore e acidità di
stomaco, gastrite e, nei casi più gravi, portare allo sviluppo di ulcere gastriche. Per questo motivo i
corticosteroidi vanno assunti preferibilmente a stomaco pieno, insieme a farmaci gastroprotettori (che
proteggono lo stomaco). A lungo andare, i corticosteroidi possono causare cambiamenti nell’aspetto dovuti a
una ridistribuzione del grasso corporeo, e gonfiore localizzato in varie parti del corpo (compreso il viso).
I corticosteroidi possono modificare il metabolismo degli zuccheri fino a causare una particolare forma di
diabete che però in genere scompare dopo la fine del trattamento. I corticosteroidi accelerano anche il
metabolismo delle ossa, che diventano più fragili e a rischio di fratture (osteoporosi).
Bortezomib, Carfilzomib, Isatuximab
Bortezomib può indurre diarrea o stipsi. Spesso porta a una riduzione temporanea del numero di piastrine
nel sangue, che si risolve quasi sempre tra un ciclo di trattamento e l’altro. Il farmaco può causare
una neuropatia, solitamente sensitiva (bruciore, alterata sensibilità al caldo/freddo, ipersensibilità al tatto),
tipicamente notturna, che colpisce soprattutto le gambe ed è reversibile.
Durante il trattamento con bortezomib si possono osservare casi di riattivazione delle infezioni da herpes
zoster, quindi è necessario effettuare una terapia profilattica antivirale.
Il carfilzomib può causare una tossicità cardiaca di tipo ischemico e aumentare il rischio di infarto o
provocare una insufficienza cardiaca. Inoltre può provocare mancanza di fiato (dispnea), ipertensione
arteriosa e disturbi gastrointestinali (diarrea).
Talidomide, Lenalidomide, Pomalidomide
La talidomide può causare diarrea, spossatezza e reazioni cutanee con arrossamento del viso e del busto.
Può causare bradicardia, ma solo in pochi casi è richiesto l’impianto di un pacemaker per correggere questo difetto. Questo farmaco può causare una neuropatia, solitamente sensitiva, con parestesie (tipo formicolii) e anestesie (riduzione della sensibilità), che colpisce principalmente le gambe. La neuropatia migliora con la sospensione del farmaco ma raramente è completamente reversibile.
La talidomide può causare inoltre trombosi venosa profonda, che si manifesta con gonfiore, dolore o rossore e colpisce solitamente le gambe, raramente le braccia. La complicazione più grave è l’embolia polmonare. Il rischio di trombosi venosa profonda è più alto durante i primi mesi di terapia, e nei pazienti che hanno
familiarità per questo disturbo per questo motivo viene effettuata una profilassi adeguata.
La lenalidomide può causare spossatezza e reazioni cutanee con arrossamento del viso e del busto. A causa della sua tossicità ematologica, può aumentare il rischio di infezioni. La lenalidomide può causare trombosi venosa profonda, che si manifesta con gonfiore, dolore o rossore e
colpisce solitamente le gambe, raramente le braccia. La complicazione più grave è l’embolia polmonare. Il rischio di trombosi venosa profonda è più alto durante i primi mesi di terapia, e nei pazienti che hanno
familiarità per questo disturbo. La pomalidomide ha una tossicità ematologica (riduzione dei valori di globuli bianchi, rossi e piastrine) maggiore.
Daratumumab, Isatuximab, Elotuzumab
Un effetto collaterale degli anticorpi monoclonali che si verifica durante o poco dopo il completamento di un’infusione (quando il farmaco viene somministrato in una vena) viene chiamato una reazione correlata all’infusione. Normalmente ciò si verifica con la prima infusione o entro poche ore dall’inizio dell’infusione.
Segni e sintomi delle reazioni correlate all’infusione possono comprendere sintomi respiratori, come naso tappato, tosse, irritazione alla gola, così come brividi, vomito e nausea. Sintomi meno comuni sono difficoltà a respirare (sibili), naso che cola, febbre, fastidio al petto, prurito della pelle, pressione arteriosa bassa o pressione arteriosa alta e liquidi nei polmoni (edema polmonare). La maggior parte delle reazioni correlate all’infusione fino ad ora sono state lievi o moderate, e si sono risolte con l’interruzione temporanea dell’infusione o con la somministrazione di farmaci per trattare l’effetto collaterale. L’infusione e i parametri vitali vengono monitorati strettamente dal personale infermieristico dedicato e il paziente viene invitato ad avvertire immediatamente infermieri o medici appena insorgano i sintomi sopra descritti.
Per ridurre la probabilità di una reazione correlata all’infusione di questi farmaci, in base alla pratica clinica standard e alle relative istruzioni per l’uso del farmaco il paziente riceverà dei farmaci, quali steroidi,
paracetamolo e antistaminici, approssimativamente 1 ora prima dell’infusione della terapia.
Possono aumentare la neutropenia e la trombocitopenia indotta dalla terapia di base. Durante il trattamento
verrà monitorato periodicamente la conta completa delle cellule ematiche.
Bites e CART
Il primo effetto collaterale è la cosiddetta tempesta citochinica o CRS, dovuta al fatto che il bispecifico o CART mette in contatto la cellula tumorale con i linfociti che, una volta attivati, possono liberare citochine in
una quantità abnorme: si tratta di molecole che causano in questo caso un’eccessiva infiammazione. Quando ciò accade si osservano effetti di grado lieve o moderato: soprattutto può presentarsi un rialzo febbrile, in alcuni casi con ipotensione, riduzione della saturazione di ossigeno e uno stato di spossatezza. Si possono manifestare casi di disorientamento e di confusione (neurotossicità), un’eventualità che riguarda, però, pochissime persone in trattamento con i bispecifici. Si tratta di effetti collaterali blandi, difficilmente
raggiungono livelli di gravità da dover essere trattati. Si può andare incontro a uno stato di immunodepressione per la riduzione degli anticorpi (immunoglobuline) che espone a un maggior rischio di infezioni. Il problema può essere risolto con la somministrazione di immunoglobuline. Per trattare alcuni effetti collaterali che possono manifestarsi durante o dopo la somministrazione il medico potrebbe somministrare farmaci come ad esempio tocilizumab, che blocca
l’azione di una proteina (una citochina) coinvolta nei processi infiammatori dell’organismo, o il cortisone, che
ha un effetto antinfiammatorio.
Il Talquetamab può provocare tossicità orali, tra cui disgeusia, bocca secca, disfagia e stomatite e reazioni cutanee, tra cui eruzione cutanea, eruzione maculo-papulare, eritema, eruzione eritematosa, nonché patologie delle unghie.
TERAPIA DI SUPPORTO
La malattia ossea richiede una terapia antidolorifica adeguata, spesso a base di farmaci oppiacei. Inoltre per ridurre il riassorbimento osseo legato alla malattia si utilizzano oggi farmaci specifici che inibiscono questi meccanismi. I bifosfonati sono la classe farmacologica più ampiamente utilizzata in questo contesto
(pamidronato, clodronato, zolendronato). Recentemente è stato introdotto Denosumab nei pazienti con insufficienza renale. L’effetto collaterale più grave dei bifosfonati è un raro danno che colpisce solitamente l’osso della mandibola
(osteonecrosi). L’osteonecrosi può essere scambiata inizialmente per una semplice alterazione delle radici dentali. Il danno osseo può essere molto doloroso, e il processo di guarigione avviene molto lentamente.
Per limitare il rischio di osteonecrosi, è consigliabile effettuare una bonifica dentale prima di iniziare la terapia con i bifosfonati. Durante il trattamento è importante curare l’igiene orale, controllare attentamente la salute della bocca ed evitare operazioni odontoiatriche. Anche dopo la fine della terapia bisogna effettuare
controlli periodici dal dentista. Altri effetti collaterali dei bifosfonati, molto più rari, sono la carenza di vitamina D e di calcio.
Per la gestione dei problemi alle ossa può anche essere utile consultare un ortopedico e fare uso di presidi ortopedici (come il busto); in alcuni casi (per esempio se ci sono danni alla colonna vertebrale) si può
ricorrere anche alla stabilizzazione chirurgica delle lesioni più a rischio di determinare fratture.
In circostanze particolari, soprattutto quando la malattia interessa unicamente una sede (mieloma solitario)
o una sede extramidollare, o quando vi sono lesioni ossee resistenti alla chemioterapia all’origine di
importanti dolori, la radioterapia rappresenta il trattamento più indicato.
In caso di anemia che non migliora pur in assenza di malattia attiva, l’utilizzo di eritropoietina può aiutare per ridurre la gravità del sintomo e migliorare la qualità di vita del paziente.
In caso di insufficienza renale grave può essere necessaria l’emodialisi.
Il deficit di immunoglobuline fisiologiche determina una particolare suscettibilità del paziente alle infezioni. È importante quindi avviare una pronta terapia antibiotica in caso di febbre. Non ci sono controindicazioni a ricevere una vaccinazione. L’unico rischio, soprattutto quando si è in trattamento, è che il vaccino non sia efficace e ci si ammali comunque.
CONSIGLI PRATICI
– Dolore. In caso si provi dolore parlare con il team medico per gestirlo al meglio. Il dolore non deve interferire sulla qualità di vita.
– Alimentazione. Alimentarsi in maniera corretta è importantissimo. Va assicurato l’apporto delle calorie e dei nutrienti necessari. Al contempo potrebbe essere utile limitare il consumo di alcuni alimenti o bevande. Alcuni medicinali e integratori comportano il rischio di interferire sulle vie metaboliche dei farmaci contro la malattia. Chiedere al team medico se si assumono prodotti di questo tipo.
– Riposo. Altrettanto importante considerare un periodo di riposo e convalescenza. Si può provare stanchezza. E’ bene curare la fisiologia del sonno per rimanere attivi durante il giorno e ritagliarsi pause durante le attività quotidiane qualora si renda opportuno.
– Benessere mentale. Avere un mieloma non significa che si debba rinunciare alle attività che più ci piacciono o che dobbiamo svolgere (es. lavoro). Naturalmente, la malattia può rivelarsi un considerevole
impegno emotivo. Ma è anche possibile superare queste difficoltà, rivolgendosi ad esempio a uno psicologo/a e confrontandosi con altre persone nella stessa situazione, tramite le associazioni.
– Attività fisica. Non fermarsi ma ritagliare del tempo per una leggera attività fisica, una passeggiata, senza eccedere, compatibilmente con lo stato di malattia ossea. Parlare con il team. L’esercizio aiuta a ridurre lo stress, la fatica, la stanchezza, migliora il sonno e l’appetito. Non sottovalutiamo questo aspetto.
Dott.ssa Annalisa Citro
UOC Ematologia, Ospedale di Legnano, ASST Ovest Milanese
Gli ultimi aggiornamenti scientifici:
Un futuro oltre la malattia: affrontare la cronicità nelle leucemie e nel mieloma
Settembre è il mese dedicato alla sensibilizzazione sui tumori del sangue e AIL ha deciso di creare delle campagne informative e di servizio per i pazienti e i loro familiari. Per quest'anno lanciamo il progetto "Un futuro oltre la malattia: affrontare la cronicità...
Trapianto di midollo e terapia genica, due tappe che hanno segnato la storia della medicina
Riportiamo l'articolo di Alessandro Malpelo apparso su Quotidiano Nazionale il 22 novembre 2020 - disponibile qui "Ogni anno, in Italia, vengono diagnosticati più di 33mila nuovi casi di tumore del sangue. Tra i più frequenti figurano i linfomi, le leucemie e il...
CAR-T e linfoma: i dati sono incoraggianti
L’immunoterapia sta rapidamente cambiando la storia clinica di pazienti che non avrebbero più avuto opzioni terapeutiche. In alcuni casi è possibile che raggiungano la guarigione con l’utilizzo di terapie innovative come le cellule CAR-T. Due recenti pubblicazioni...
Nuovi dati clinici sulle terapie CAR-T
Un nuovo studio dell’Istituto Nazionale dei Tumori, reso possibile anche grazie al contributo di AIL Milano, dimostra le potenzialità delle terapie a base di cellule CAR-T per i malati onco-ematologici.
Come verranno decisi i centri per l’erogazione delle CAR-T?
Sebbene i farmaci siano disponibili, la macchina organizzativa per la somministrazione delle terapie a base di linfociti ingegnerizzati è ancora in alto mare. Gli esperti, riuniti a convegno, immaginano un modello efficiente e capace di garantire equità di accesso sul...
Mieloma multiplo, nuove speranze dalla terapia con CAR-T
Pazienti pluritrattati rispondono alla terapia CAR-T, in alcuni casi in modo completo. Sono i risultati degli studi presentati al congresso di ematologia negli Usa. I dati su efficacia e sicurezza per questa malattia, però, non sono ancora definitivi “Risultati...